Урок по химии в 11 классе по теме «Теория электролитической диссоциации»
Учитель: Белякова Н.В.
МОУ «Краснохолмская сош №1», 2009 год
Цель: Систематизировать знания учащихся по теме ТЭД.
Задачи:
- Отработать основные понятия и положения по теме «ТЭД».
- Развитие умений объяснять свойства веществ на основе их строения. Составлять схемы диссоциации электролитов на ионы, умений работать с компьютером и интерактивной доской.
- Воспитание самостоятельности, ответственности, уверенности в себе.
Оборудование: компьютеры, интерактивная доска, электронная презентация.
План
1. Оргмомент. Проверка готовности к уроку.
1.1. Сообщение темы урока и его задач (слайды 1,2).
1.2. Краткая информация об авторах ТЭД (слайд 3).
1.3. Заготовка таблицы-кластера (слайд 4).
2. Стадия вызова: прием «мозговой штурм» - 2-3 мин.
Мы с вами знакомились с некоторыми понятиями и положениями ТЭД в 8 классе. Работая в парах, вспомните, какие понятия теории вам известны? Занесите их в таблицу
(заслушиваются ответы ребят, вспоминаются понятия «электролиты», «неэлектролиты», «электролитическая диссоциация»).
3. Стадия осмысления:
3.1. Самостоятельная работа с текстом, расположенном на рабочем столе компьютера «Текст» (см. ниже).
Задание: Изучить текст в течение 5-7 минут. Занести новые понятия в графу 1 таблицы.
Ответить на вопросы к тексту.
3.2. Задание: Озвучить видеоролик «Механизм ЭД», используя материал текста (на подготовку дается 1-2 минуты, назначаются рецензенты).
Проверка заполнения графы 1 кластера – беседа.
Ответы на вопросы к тексту – беседа.
3.3. Задание: составить на интерактивной доске схемы диссоциации кислот, солей, оснований (слайды 5,6,7 ), дать определение им как электролитам.
3.4. Объяснение ступенчатой диссоциации многоосновных кислот с помощью интерактивной доски (слайд 8).
Ребята самостоятельно с помощью интерактивной доски составляют формулы и схему ступенчатой диссоциации гидросульфата натрия и гидроксохлорида магния.
3.5. Выполнение заданий (слайды 9,10) – первичная проверка.
З.6. Слайд 11 : Показать на схеме, куда будут двигаться ионы в электрическом поле.
3.7. Слайд 12: Что общего у изображенных веществ? Определите силу каждого из веществ как электролита. Какую величину мы используем для определения силы электролита?
3.8. Слайд 13: Составьте на интерактивной доске формулу для расчета степени электролитической диссоциации.
4. Стадия рефлексии:
4.1. Работа с кластером.
Попытаемся, используя материал урока сформулировать некоторые положения ТЭД (слайд 14).
4.2. Фронтальная работа по выполнению заданий части А КИМов ЕГЭ по химии (слайд 15)
5. Д/з (слайд 16): стр. 148-150 учебника О.С. Габриеляна «Химия-11»,
Всем: №2,3,4 стр.156 - письменно.
*Задача: Определить количество вещества и число ионов натрия, образующихся при диссоциации 2 молей ортофосфата натрия. Считать, что степень диссоциации соли 100%.
6. Поставим себе оценку за работу на уроке (выполнение заданий на слайде 17 «Найди ошибку»).
«ТЕКСТ»
В процессе электролитической диссоциации (распаде электролитов на ионы) большую роль играют молекулы воды. Между атомами водорода и кислорода имеются расположенные под углом около 1050 ковалентные сильнополярные связи. Поэтому молекулы воды полярны и представляют собой диполи: 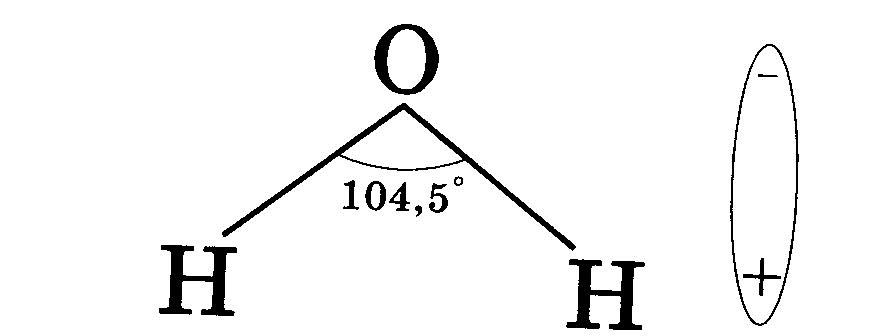 При растворении в воде веществ с ионной связью, например хлорида натрия, молекулы воды притягиваются своими отрицательными полюсами к положительно заряженным ионам натрия, а положительными полюсами – к отрицательно заряженным хлорид-ионам. В результате связь между ионами ослабляется, и кристаллическая решетка разрушается (рис.1). Таким образом, все ионы в растворе связаны с молекулами воды. Такие ионы называются гидратированными, а процесс их образования гидратацией. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
При растворении в воде веществ с ионной связью, например хлорида натрия, молекулы воды притягиваются своими отрицательными полюсами к положительно заряженным ионам натрия, а положительными полюсами – к отрицательно заряженным хлорид-ионам. В результате связь между ионами ослабляется, и кристаллическая решетка разрушается (рис.1). Таким образом, все ионы в растворе связаны с молекулами воды. Такие ионы называются гидратированными, а процесс их образования гидратацией. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
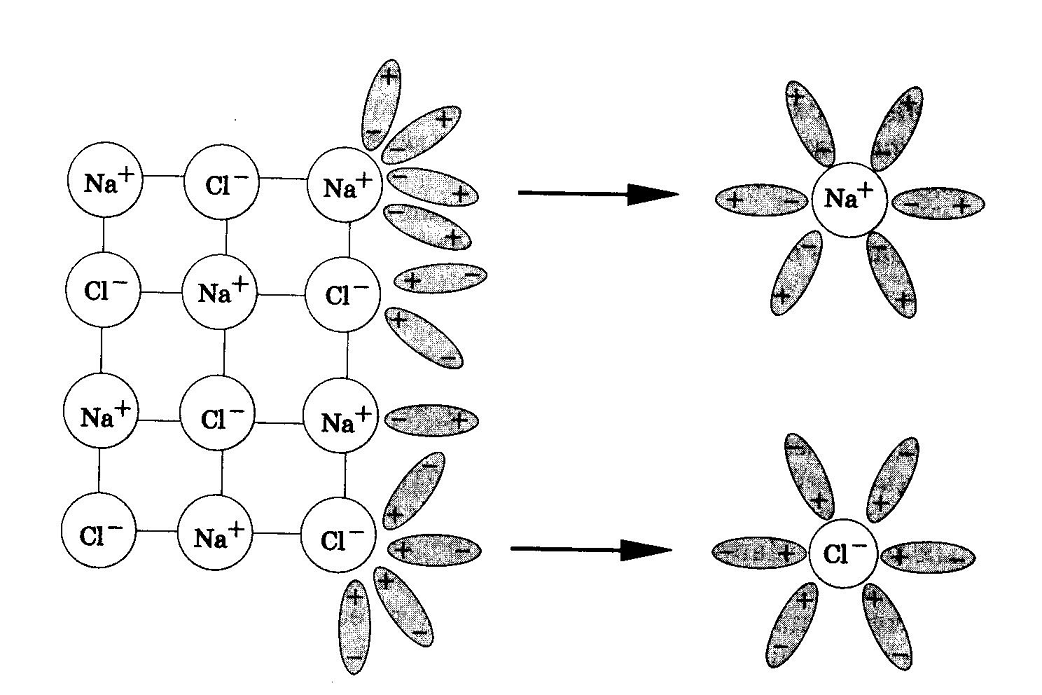
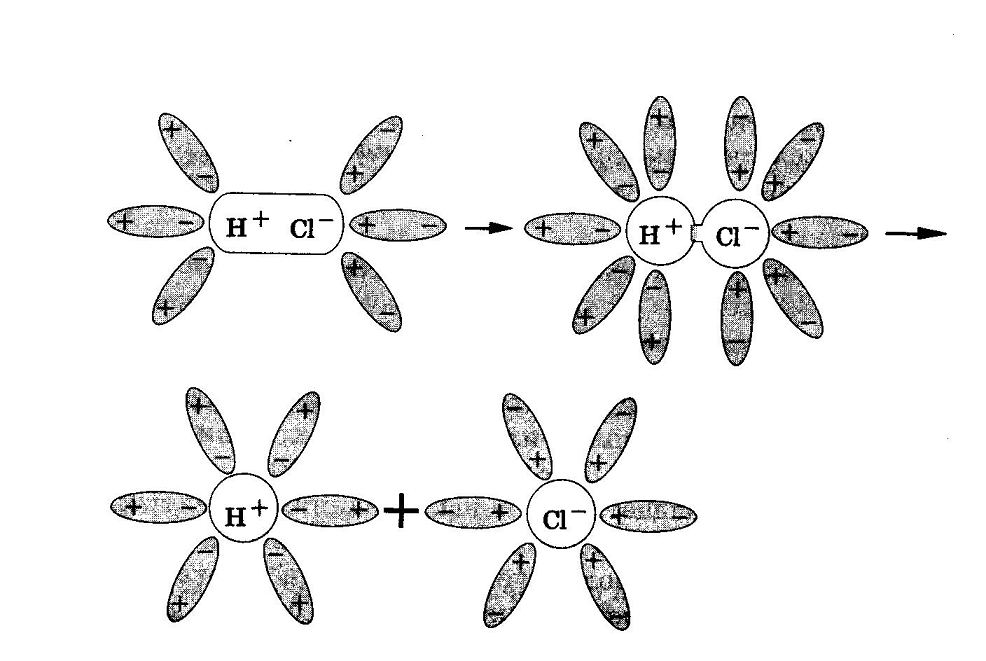
Рис.1. Диссоциация NaCl Рис.2. Диссоциация HCl
При растворении в воде веществ с ковалентной сильнополярной связью, например хлороводорода, происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Затем ионная связь разрывается и в раствор переходят гидратированные ионы водорода (Н3О+-ион гидроксония) и хлорид-ионы (рис.2).
При расплавлении электролитов усиливаются колебательные движения частиц за счет увеличения их энергии, что приводит к ослаблению связи между ними. В результате чего разрушается кристаллическая решетка.
Для количественной характеристики ЭД используют понятие степень ЭД (α), которая равна отношению числа молекул, распавшихся на ионы к общему числу растворенных молекул. Она измеряется в долях от единицы или в %.
В зависимости от значения степени ЭД электролиты бывают:
- сильные (α →100%): HCl, HNO3, H2SO4, HВr, HI, щелочи, почти все соли;
- слабые (α →0%): H2S, H2CO3, H2SO3, H2SiO3, органические кислоты, нерастворимые основания , гидроксид аммония.
Вопросы:
1. Как вы думаете, будут ли электролиты диссоциировать на ионы при растворении их в керосине?
2. Назовите основные причины диссоциации электролитов на ионы при растворении их в воде и расплавлении.
3. В чем отличие диссоциации веществ с ковалентной полярной связью от диссоциации веществ с ионной связью?


